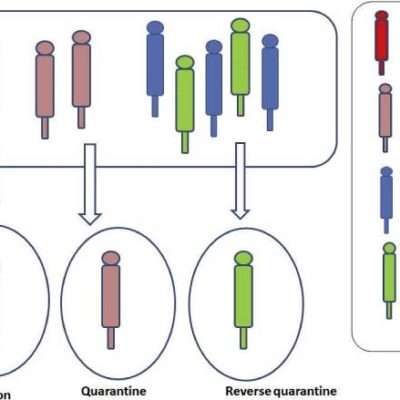
先日、ゲイツ君が新型コロナウイルス変異型に対して、3回接種の可能性をほのめかしていました。

この3回目の接種は、新型コロナウイルスの変異型に対するものを指していますが、それに関して米国食品医薬品局(FDA)の新型コロナウイルスワクチンの緊急使用に関するガイダンスが2021年2月22日に発表されています(『Emergency Use Authorization for Vaccines to Prevent COVID-19 Guidance for Industry』FDA, Document issued on February 22, 2021)。

この中で、過去記事でお伝えしたように、南アフリカでの新型コロナウイルス変異型(B.1.351 lineage)は、アストラゼネカの遺伝子ワクチンはプラセボと差が出ない(つまり、効果がない)ことを明確に認めています。
この新型コロナウイルス変異型に対する緊急ワクチン製造に関するガイダンスでは・・・・
新型コロナウイルス変異型に対する新しいワクチンは、オリジナルの新型コロナウイルス遺伝子ワクチンとの比較の臨床試験だけでよいとしています。
急ごしらえで作ったワクチンは、通常の臨床試験(フェーズ1〜3)も飛ばして、オリジナルの新型コロナウイルス遺伝子ワクチンとの抗体比較だけでよいとしているのです。
おいおい・・・・・
しかも、将来的にはその比較試験もなしに、使用許可することも検討するとしています(『Coronavirus (COVID-19) Update: FDA Issues Policies to Guide Medical Product Developers Addressing Virus Variants』 FDA, February 22, 2021)。

安全性の確認は必要ないというは、人体実験であり、第二次世界大戦後に制定されたニュルンベルグ綱領違反(3月の「現代医学と優生思想」講義で詳述します)そのものです。
みなさんは、医薬品のジェネリック(ゾロ製品)というものをご存知だと思います。
ジェネリック製品とは、元々の先発の医薬品の特許が切れた場合に、他社がその製品の化学構造や添加物を少し変えたものを安価に売り出したものです。
1980年代前半までは、ジェネリック医薬品も先発医薬品と同様、承認申請にあたっては臨床試験が義務付けられていました。

しかし、有効成分が同じであるジェネリック医薬品が、先発医薬品で実施された臨床試験を重複して行うことは、時間と経費の無駄であり、安価なジェネリック医薬品を早く提供するという趣旨に反するとの考え方に基づき、1984年に米国において、ジェネリック医薬品の簡略承認申請を認めたハッチ・ワックスマン法が成立しています。
これが世界的なスタンダードとなっているため、ジェネリック医薬品に関しての安全性を確認する臨床試験は行われていません(先発医薬品そのものも安全性の試験は怪しいものばかりですが・・・・)。
今回の緊急使用の新型コロナ変異型に対する急造ワクチンもこのジェネリックと同じ考え方ということです。

これが現代医学の実態です。
ヒポクラテスの「First do not harm」とは真逆の世界が合法化されているということです(^_−)−☆。